由耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus, MRSA) 生物膜感染引起的骨髓炎难以根除,甚至可能危及患者的生命。金黄色葡萄球菌在骨髓炎发病机制中的一个重要和深入研究的机制是生物膜的形成,已被广泛综述。坏死骨和植入物表面的金黄色葡萄球菌生物膜极难处理,因为它们限制了抗生素向细菌细胞的扩散,抑制了免疫细胞的渗透,并抵抗了机械破坏。鉴于生物膜形成的MRSA感染在骨组织中持续存在且根深蒂固,控制并有效治疗骨髓炎仍然具有挑战性。
为开发有效的MRSA感染的骨髓炎治疗方案,南开大学的研究团队近期的研究提出了一种可活化的纳米结构(Au/TNT@PG),用于协同声动力催化治疗由MRSA感染的骨髓炎。
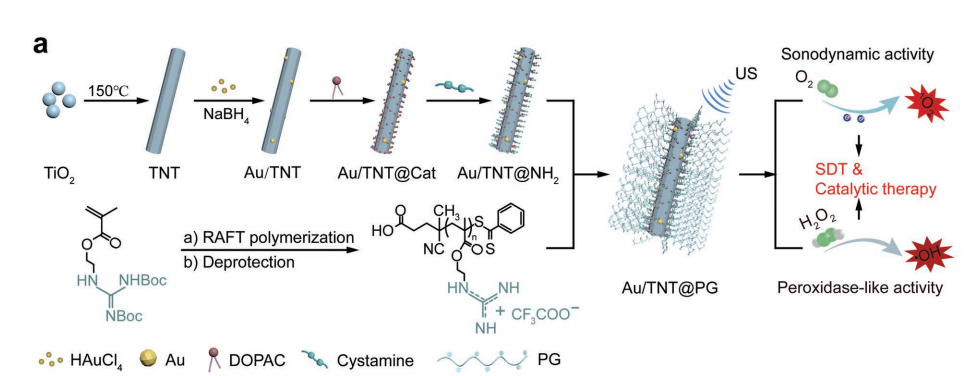
Au/TNT@PG主链是通过将富含胍的聚合物(PG)与吸收超声(US)的掺金钛酸盐纳米管(Au/TNT)结合而获得的。PG对富含负电荷成分的基质具有较强的亲和性,通过静电相互作用与带负电的微生物膜(磷酸头基团)结合,能穿透生物膜消除物理屏障;核心成分Au/TNT表现出过氧化物酶样活性,该活性由酸性感染微环境触发,产生1O并在酸性感染微环境中催化内源性H2O2的分解转化为具有毒性的OH自由基(•OH),从而杀死细菌。纳米复合材料Au/TNT@PG强大的抗菌效果归因于其细菌捕获能力、正电荷胍的生物膜穿透性以及随后的Au/TNT声动力学催化作用的协同效应。在深穿透超声波(US)照射下,Au/TNT的催化过程能够被加速。这种远程控制的方法增强了巨噬细胞向M2型的极化,同时抑制了M1型,导致局部炎症消退并增强了成骨细胞增殖和分化,从而抑制了骨丢失。这项研究为骨髓炎的有效声动力催化治疗提供了一种通用的纳米治疗方法。
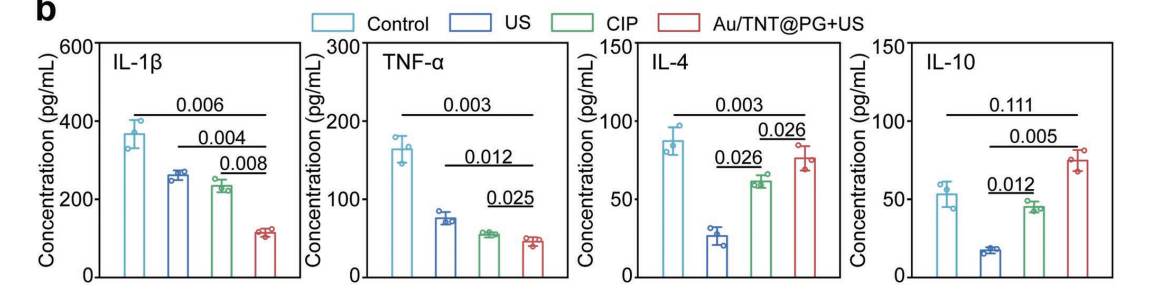
结合声动力疗法(US)与纳米复合材料Au/TNT@PG的治疗方案在大鼠骨髓炎模型中得到了进一步探讨。将MRSA悬浮液注射到大鼠胫骨骨髓腔中,成功建立了大鼠骨髓炎的动物模型,以US+Au/TNT@PG组作为实验组,与对照组(PBS)、环丙沙星组(CIP)与声动力组(US)进行比较。PBS、CIP、US组大鼠MRSA感染的胫骨与正常腿相比出现了严重的骨髓炎症状(如骨溶解、骨膜反应和隔离膜形成等),而Au/TNT@PG+US组大鼠骨髓炎模型中能够观察到MRSA生物膜感染的显著消除和骨侵蚀的抑制。值得注意的是,纳米复合材料介导的抗炎细胞因子表达缓解了局部炎症,并抑制了骨丢失。
以上研究成果发布在Advanced Materials(IF=32.086)文献“Guanidinium-Decorated Nanostructure for Precision Sonodynamic-Catalytic Therapy of MRSA-Infected Osteomyelitis”中,此项研究中,使用了欣博盛生物(NeoBioscience Technology Co, Ltd)的Rat IL-1β, IL-4, IL-10 和TNF-α ELISA试剂盒在大鼠骨髓组织匀浆样本中评估这些细胞因子的含量。
文献内产品相关图片
文献基础信息页

产品引用页

产品相关数据信息(图片来自文章原文)

文章原文链接
https://pubmed.ncbi.nlm.nih.gov/36245331/
参考文献:
Cheng, Y., et al. (2022). "Guanidinium-Decorated Nanostructure for Precision Sonodynamic-Catalytic Therapy of MRSA-Infected Osteomyelitis." Adv Mater: e2206646.


