
近期,苏州大学程亮教授团队在Advanced Materials(IF=27.4)上发表题为“Manganese Galvanic Cells Intervene in Tumor Metabolism to Reinforce cGAS-STING Activation for Bidirectional Synergistic Hydrogen-Immunotherapy.(锰原电池调控肿瘤代谢以增强cGAS-STING激活,实现双向协同氢免疫疗法)”的研究。研究团队开发了一种锰原电池(Mn galvanic cells,MnG)策略,通过调节肿瘤代谢以进一步增强cGAS-STING激活,进而实现高效双向协同氢免疫疗法。
欣博盛生物非常荣幸能够作为供应商为该项研究提供高品质ELISA试剂盒,为生物医学领域的科研探索贡献一份力量。
引用产品
该项研究中,使用了欣博盛生物(NeoBioscience Technology Co, Ltd)的Mouse TNF-α ELISA Kit,用于检测肿瘤组织中相关指标的含量。
货号 | 产品名称 | 灵敏度 | 检测范围 |
QuantiCyto® Mouse TNF-α ELISA kit (小鼠肿瘤坏死因子-α) | 15.6pg/ml | 31.25-2000pg/ml |


研究详情
cGAS-STING通路在触发抗肿瘤免疫以及将“冷”肿瘤转变为“热”肿瘤的过程中起到关键作用。前期大量研究结果表明,Mn2+可以增强cGAS-STING通路的激活,从而提高肿瘤治疗效果。然而,肿瘤复杂的代谢微环境对cGAS-STING通路的激活有潜在影响。据报道,肿瘤代谢过程,尤其是糖酵解过程,能够负向调控cGAS-STING通路的激活。因此,开发高效策略以实现锰基STING激动剂有效递送的同时,调控肿瘤细胞糖酵解进一步增强cGAS-STING通路激活具有重要意义。近日,苏州大学程亮教授团队开发了一种锰原电池(Mn galvanic cells,MnG)策略,通过调节肿瘤代谢以进一步增强cGAS-STING通路的激活,进而实现高效双向协同氢免疫疗法,显著提升肿瘤治疗疗效的目的。
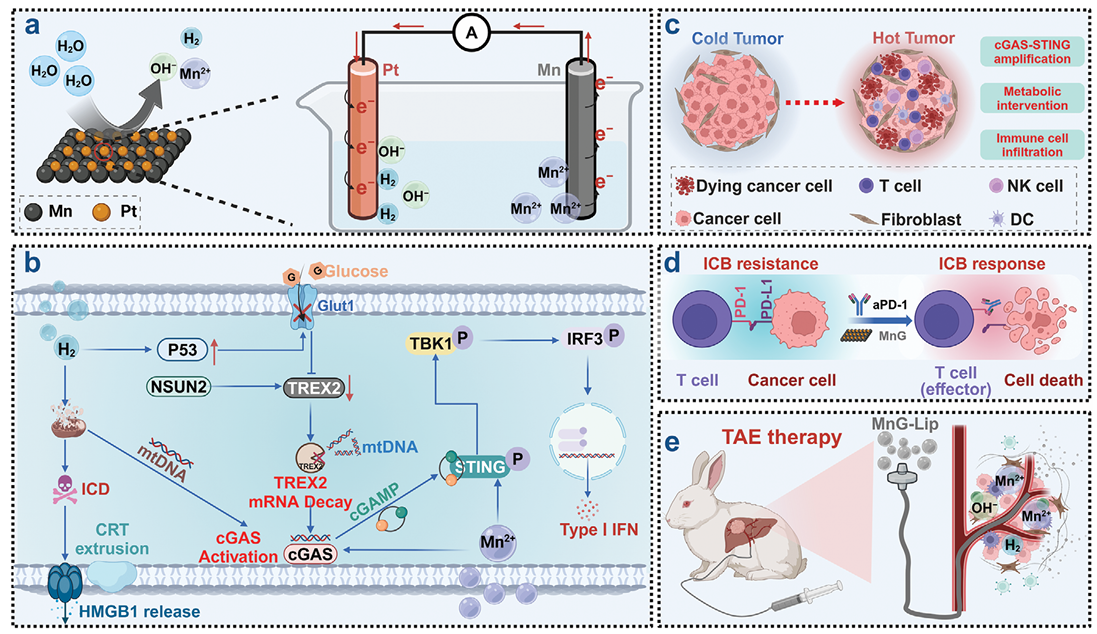
(MnG调节肿瘤代谢以增强cGAS-STING通路激活示意图)
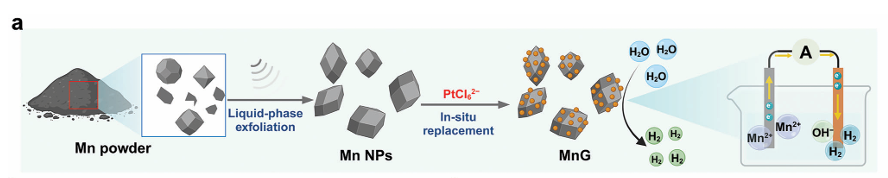
(MnG的制备过程及氢气生成机制的示意图)
首先,研究团队通过液相剥离和原位置换技术,将锰粉转化为均匀的锰纳米颗粒(MnNPs),并成功构建了MnG。MnG具有高度的水反应活性,水中自发产生氢气,且性能优于单独的MnNPs,实现了从非活性锰粉中高效生成氢气的目的。进一步的实验表明,100 μg/mL的MnG能够显著抑制细胞增殖,且在低pH环境下具有更强的产氢能力。MnG处理诱导的细胞死亡会影响线粒体功能,并能够促进免疫原性细胞死亡标志物的释放。这些结果表明,MnG通过产氢有效抑制细胞增殖并激发免疫反应。
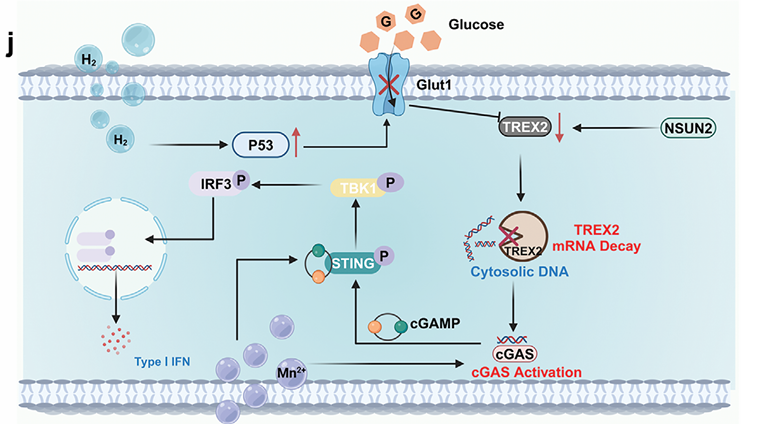
(葡萄糖代谢干扰增强MnG诱导的cGAS-STING激活的示意图)
P53通过调控肿瘤代谢抑制肿瘤生长,而氢气能够激活P53通路,诱导肿瘤细胞死亡。实验表明,MnG处理会显著上调P53,抑制糖酵解,减少ATP和乳酸的生成,并下调TREX2表达,从而增强cGAS-STING通路激活。此外,MnG处理可以显著促进树突状细胞成熟,增强cGAS-STING通路相关蛋白的磷酸化水平。这些结果表明,MnG通过调节葡萄糖代谢和释放Mn2+,协同激活cGAS-STING通路,增强抗肿瘤免疫反应。
研究团队利用锰基生物反应器(具有原电池结构)探索了其在实现体内协同抗肿瘤治疗中的潜在应用。超声成像显示,MnG注射后肿瘤内持续产生氢气超过12小时,显著中和了酸性肿瘤微环境(TME)。实验表明,MnG能够显著抑制肿瘤生长,延长小鼠生存期,并且未表现出明显的副作用。其中,通过酶联免疫吸附测定(ELISA)检测细胞因子水平的变化,发现在MnG治疗后,干扰素(IFN-β、IFN-γ)和肿瘤坏死因子-α(TNF-α)的水平均有显著增加,表明cGAS-STING通路、T细胞和NK细胞的激活和浸润显著增强。
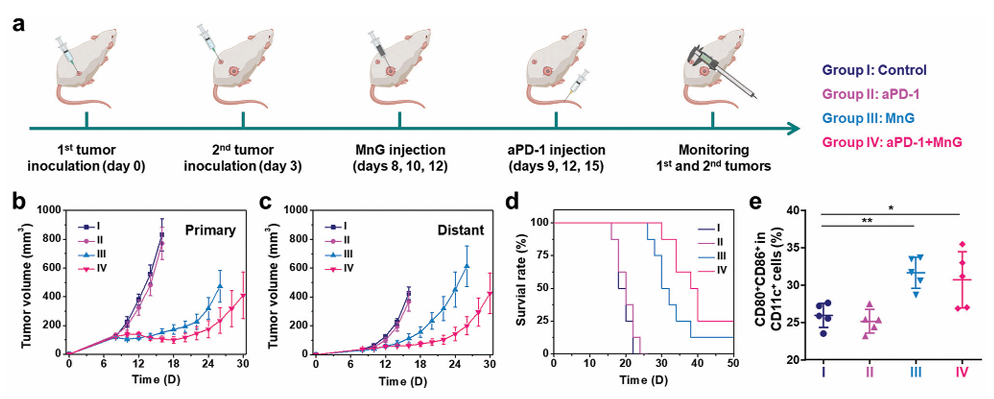
(MnG诱导的氢免疫疗法与aPD-1 ICB疗法联合应用的肿瘤治疗过程示意图)
将MnG与aPD-1免疫检查点阻断(immune-checkpoint blockade,ICB)治疗相结合,实验结果表明,MnG和aPD-1 ICB疗法的联合使用对肿瘤产生了最佳的治疗效果,显著延长了小鼠的生存时间,并抑制了远端肿瘤的生长。在后续实验中,团队证明了MnG或联合治疗通过调节肿瘤微环境,激活先天和适应性免疫反应,显著提高了aPD-1 ICB的治疗响应率。
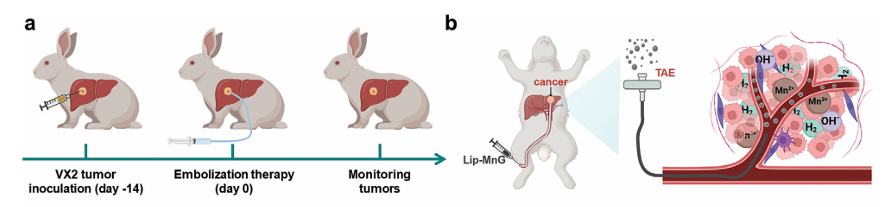
a)使用Lip-MnG进行氢增强的TAE治疗的体内治疗方案.
b)在兔原位肝肿瘤模型中进行体内TAE-H2免疫疗法示意图
在兔原位肝肿瘤模型中,研究团队将MnG进一步分散在临床中用于TAE治疗的碘油中,MnG-碘油分散液可通过联合经导管动脉栓塞术(TAE)、气体治疗和免疫治疗,产生显著的疗效。
综上所述,该研究不仅强调了通过有效构建金属原电池策略诱导生物学效应以增强免疫治疗的重要性,还证明了该策略在调节肿瘤糖代谢增强cGAS-STING激活以实现协同治疗的可行性,为合理设计生物活性材料及其在肿瘤免疫治疗中的应用提供了进一步的发展机会。
该项工作的第一作者是苏州大学博士后杨乃霖,通讯作者为苏州大学程亮教授。
文献引用
Yang N, Sun S, Xu J, et al. Manganese Galvanic Cells Intervene in Tumor Metabolism to Reinforce cGAS-STING Activation for Bidirectional Synergistic Hydrogen-Immunotherapy
[J]. Advanced Materials, 2025: 2414929.
(原文链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/adma.202414929)


